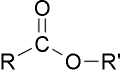
 estructuras de los èsteres
estructuras de los èsteresEn la química, los ésteres son compuestos orgánicos en los cuales un grupo orgánico (simbolizado por R' en este artículo) reemplaza a un átomo de hidrógeno (o más de uno) en un ácido oxigenado. Un oxoácido es un ácido inorgánico cuyas moléculas poseen un grupo hidroxilo (–OH) desde el cual el hidrógeno (H) puede disociarse como un ión hidrógeno, hidrón o comúnmente protón, (H+). Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
Nomenclatura
La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:
- La primera parte del nombre, etanoato (acetato), proviene del ácido etanoico (acético)
- La otra mitad, de metilo, proviene del alcohol metílico (metanol).
En el dibujo de la derecha se observa la parte que procede del ácido (en rojo; etanoato) y la parte que procede del alcohol (en azul, de etilo).
Luego el nombre general de un éster de ácido carboxílico será "alcanoato de alquilo" donde:
- alcan-= raíz de la cadena carbonada principal (si es un alcano), que se nombra a partir del número de átomos de carbono. Ej.:Propan- significa cadena de 3 átomos de carbono unidos por enlaces sencillos.
- oato = sufijo que indica que es derivado de un ácido carboxílico. Ej: propanoato: CH3-CH2-CO- significa "derivado del ácido propanoico".
- de alquilo: Indica el alcohol de procedencia. Por ejemplo: -O-CH2-CH3 es "de etilo"
En conjunto CH3-CH2-CO-O-CH2-CH3 se nombra propanoato de etilo.
| | |
Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno.

Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional.

Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......)

Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster.


Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional.

Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......)

Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster.

Propiedades físicas
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
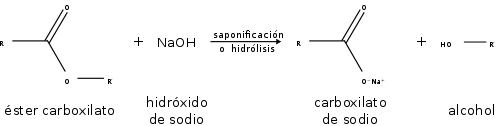
Reacción de saponificación o hidrólisis.
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como dadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidro-solubles que los hidrocarburos de los que derivan. Pero las limitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como dador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico.
Los ésteres se descomponen por la acción del agua en sus correspondientes ácidos y alcoholes, una reacción que es catalizada por la presencia de los ácidos. Por ejemplo, el etanoato de etilo se descompone en ácido etanoico y etanol. La conversión de un ácido en un éster se denomina esterificación. La reacción entre un éster y una base se conoce como saponificación. Cuando se produce la descomposición de un éster por su reacción con agua, se dice que el éster ha sido hidrolizado.
En general, los ésteres de los ácidos orgánicos son líquidos neutros, incoloros, con olor agradable e insolubles en agua, aunque se disuelven con facilidad en disolventes orgánicos. Muchos ésteres tienen un olor afrutado y se preparan sintéticamente en grandes cantidades para utilizarlos como esencias frutales artificiales, como condimentos y como ingredientes de los perfumes.
Usos y aplicaciones
Los ésteres son compuestos líquidos y sólidos que poseen olores agradables, los cuales se encuentran distribuidos ampliamente en la naturaleza en flores y frutas. En el comercio son utilizados como materia prima en perfumes y esencias saborizantes, confiterías, solventes, agentes sintéticos, y para la preparación de plásticos.
- metanoato de metilo o formiato de metilo (HCOOCH3): olor a ron
- metil butanoato, butanoato de etilo o butirato de etilo (CH3(CH2)2COOCH2CH3): olor a piña
- metil salicilato o aceite de siempreverde se utiliza para aromatizar algunos productos farmacéuticos especialmente pomadas
- octanoato de heptilo, metanoato de isobulo o formiato de isobutilo (HCOOCH2CH( CH3)2): olor a frambuesa
- pentil etanoato, etanoato de pentilo o acetato de n-amilo (CH3COOCH2(CH2)3CH3: olor a plátano
- pentil pentanoato: olor a manzana
- pentil butanoato, butanoato de pentilo o butirato de pentilo (CH3(CH2)2COOCH2(CH2)3CH3): olor a pera o a albaricoque
- octil etanoato, etanoato de octilo o acetato de n-octilo (CH3COOCH2(CH2)6CH3): olor a naranja.
El salicilato de metilo se emplea principalmente como agente aromatizante y posee la ventaja de que se absorbe a través de la piel. Una vez absorbido, el salicilato de metilo puede hidrolizarse a ácido salicílico, el cual actúa como analgésico. Este producto puede extraerse de varias plantas medicinales capaces de aliviar el dolor.
Los ésteres como el etanoato de isoamilo (aceite de plátano), el etanoato de etilo y el etanoato de ciclohexanol, son los principales disolventes en las preparaciones de lacas. Otros ésteres, como el ftalato de dibutilo y el fosfato de tricresilo se usan como plastificadores en las lacas. El etanoato de amilo se emplea como cebo odorífero en venenos para la langosta, y algunos de los metanoatos son buenos fumigantes. Los ésteres tienen también importancia en síntesis orgánica.
Además, estos compuestos tienen aplicaciones médicas importantes. El nitrito de etilo es diurético y antipirético. El nitrito de amilo se usa en el tratamiento del asma bronquial y de las convulsiones epilépticas, y como antiespasmódico. La nitroglicerina y el nitrito de amilo producen la dilatación de los vasos sanguíneos, disminuyendo por tanto la presión sanguínea. El chaulmugrato de etilo se ha empleado en el tratamiento de la enfermedad de Hansen. El sulfato de dimetilo (utilizado con frecuencia en síntesis orgánica como agente desnaturalizador) y el sulfato de dietilo son extremamente peligrosos en forma de vapor, y deben ser manejados con cuidado.
Los ésteres de ácidos salicílico se utilizan en medicina. Ejemplo: el ácido acetil salicílico (aspirina), el salicilato de metilo y el salicilato de fenilo. El ácido acetilsalicílico o aspirina, como es conocido comercialmente, es el más popular de los medicamentos sintéticos, esto se debe a su acción analgésica, antipirética, anti-inflamatoria y antirreumática, además de ser utilizada en la prevención del infarto de miocardio, su bajo costo, obtención y adquisición, aunque se conocen numerosos compuestos con dichas propiedades analgésicas, en la aspirina se encuentran presentes ambos efectos. Es por ello que la aspirina se usa en muchas preparaciones conjuntamente con un gran número de otros medicamentos.
Las industrias químicas producen cantidades de esteres, del orden de centenares de millones de kg por año. Son de especial importancia el acetato de etilo, acetato de butilo, dibutilftalato, acetato y xantogenato de celulosa, trinitrato de glicerilo, acetato de vinilo y nitrato de celulosa.
Propiedades químicas
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.
Los ésteres se pueden hidrolizar a su ácido y su alcohol precursores. Recordar que en la reacción de hidrólisis, una molécula de agua se rompe y se adiciona a otra molécula. Para aumentar la velocidad de las reacciones de hidrólisis de los ésteres se agregan ácidos o bases inorgánicas y se calienta la mezcla.
Si los ésteres se hidrolizan en una solución alcalina, la reacción de hidrólisis se denomina saponificación. El término saponificación significa fabricación de jabón. Los jabones, o sea las sales solubles de los ácidos grasos, se preparan calentando las grasas de plantas o animales en una solución básica de alcohol y agua.

No hay comentarios:
Publicar un comentario